2024年9月9日,复宏汉霖(2696.HK)宣布,公司自主研发的创新型单抗H药 汉斯状®(斯鲁利单抗)小细胞肺癌领域最新研究结果以壁报形式在2024年世界肺癌大会(World Conference on Lung Cancer, WCLC)上发布。
H药 汉斯状®(斯鲁利单抗)是全球首个一线治疗小细胞肺癌的的抗PD-1单抗,已在中国、印尼、柬埔寨、泰国等地获批上市。目前,H药在中国已获批用于治疗微卫星高度不稳定(MSI-H)实体瘤、鳞状非小细胞肺癌(sqNSCLC)、广泛期小细胞肺癌(ES-SCLC)及食管鳞状细胞癌(ESCC),覆盖肺癌、消化道肿瘤等高发肿瘤,累计惠及约8万名患者。
肺癌是全球最常见的恶性肿瘤之一。其中SCLC约占肺癌总数的15%[1],是肺癌中侵袭性最强的亚型,分为局限期小细胞肺癌(LS-SCLC)和ES-SCLC。截至目前,H药一线治疗ES-SCLC的适应症已在中国、印尼、柬埔寨和泰国获批,其欧盟上市许可申请(MAA)也已获得欧洲药品管理局 (EMA) 受理,有望于今年获批上市。同时,公司围绕H药在肺癌一线治疗全面布局,开展了针对sqNSCLC、ES-SCLC和LS-SCLC的多项国际多中心III期临床试验,并在美国启动了一项H药对比一线标准治疗阿替利珠单抗用于ES-SCLC的头对头桥接试验。
此次2024 WCLC大会的H药研究数据结果如下:
ASTRUM-005R研究
论文题目
ASTRUM-005R:斯鲁利单抗联合化疗一线治疗广泛期小细胞肺癌的真实世界多中心研究
试验设计
这是一项评估斯鲁利单抗联合化疗一线治疗ES-SCLC疗效和安全性的多中心、真实世界队列研究。纳入2022年4月至2024年4月在中国14家研究中心接受至少两个周期斯鲁利单抗联合依托泊苷和铂类一线治疗的ES-SCLC患者,并且至少进行一次疗效评估,主要研究终点为真实世界无进展生存期(rwPFS),次要终点包括总生存期(OS)、客观缓解率(ORR)、安全性。
结果
研究共入组538例患者进行疗效和安全性分析。中位年龄为63(范围:57.00~68.75)岁,467例(86.80%)为男性患者,406例(75.46%)患者有吸烟史。ECOG PS 为 0 或 1患者占多数(491,91.26%)。排除其他原发性肿瘤外,237例(44.05%)伴有合并症。肝转移和脑转移发生率分别为33.09%和21.56%。免疫联合化疗的中位治疗周期数为4(范围:4~6)周期,222例(41.26%)患者接受了超过4周期的治疗。
疗效数据显示,中位 rwPFS 为 9.1 个月(95% CI:8.1~9.7),1 年 rwPFS 率为 34.6%,超过 ASTRUM-005 研究亚裔人群的 1 年 PFS 率 28.2%,2 年 rwPFS 率为 11.3%。无肝转移患者的中位 rwPFS 为 9.7 个月(95%CI:8.8~12.8)显著优于肝转移患者的 7.4 个月(95%CI:6.2~8.9)(P < 0.0001),接受 >4 周期免疫联合化疗较接受 ≤4 周期免疫联合化疗治疗的患者中位 rwPFS显著提高( 10.5 个月(95%CI:9.3~13.3)vs 6.7 个月(95% CI: 6.3~9.1)(P< 0.0001))。ORR为71.29%,OS尚未成熟。安全性方面,AESI发生率为38.85%,其中≥3级AESI为15.43%。
结论
斯鲁利单抗联合化疗一线治疗ES-SCLC的真实世界生存结果,为临床实践提供有价值的见解,验证了ASTRUM-005研究结果,为斯鲁利单抗联合依托泊苷和铂类一线治疗ES-SCLC补充有力证据。
一项回顾性研究
论文题目
免疫联合化疗对比化疗新辅助治疗局限期小细胞肺癌:一项回顾性研究
试验设计
研究纳入2018年1月至2023年10月接受新辅助PD-L1/PD-1抑制剂联合铂类化疗或单纯铂类化疗后进行手术切除的LS-SCLC患者。主要研究终点为病理完全缓解(pCR)和主要病理缓解(MPR)。次要研究终点包括R0切除率、降期率和无病生存期(DFS)。
结果
研究入组51例患者,其中26例接受免疫联合化疗新辅助治疗(14例(53.8%)接受斯鲁利单抗联合化疗新辅助治疗),25例接受化疗新辅助治疗,男性和女性患者分别有39名和12名。免疫联合化疗组和化疗组的平均年龄分别为 61.6(43.1~74.5)岁和 59.5(45.8~73.2)岁(表1)。
疗效数据显示,免疫联合化疗组和化疗组的pCR分别为 38.5%和 8.0%(OR 7.2,95% CI:1.4~37.3)。免疫联合化疗组和化疗组的MPR分别为 53.8%和12.0%(OR 8.6,95% CI:2.0~35.8)。免疫联合化疗组和化疗组R0切除率分别为92.3%和80.0%(OR 3.0,95% CI:0.5~17.2)。免疫联合化疗组较化疗组的病理降期率(88.5% vs 36.0%)和N2降期率(68.2% vs 24.0%)均提升(表2)。中位随访时间为17.2个月,免疫联合化疗组的中位DFS尚未达到,化疗组的中位DFS为11.3(95% CI:6.1~16.5)个月。
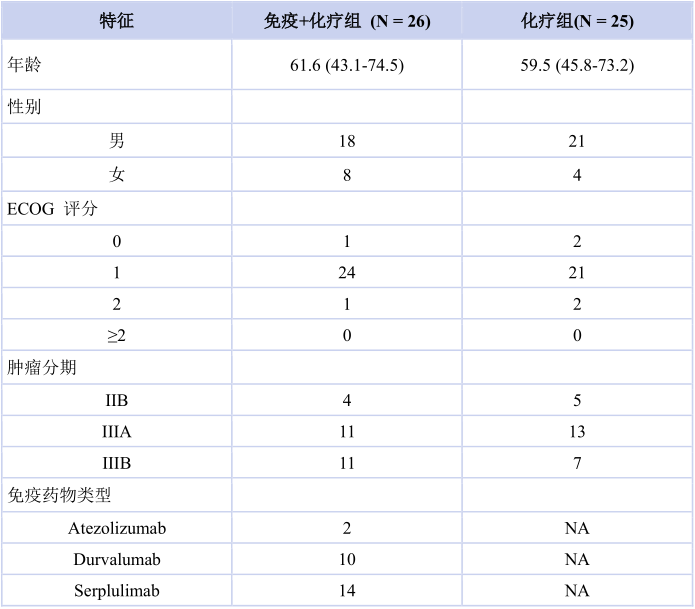
表1 患者基线特征
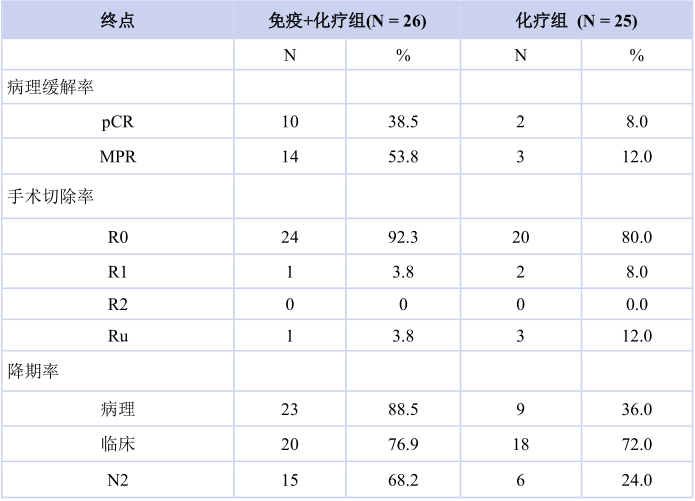
表2 研究结果
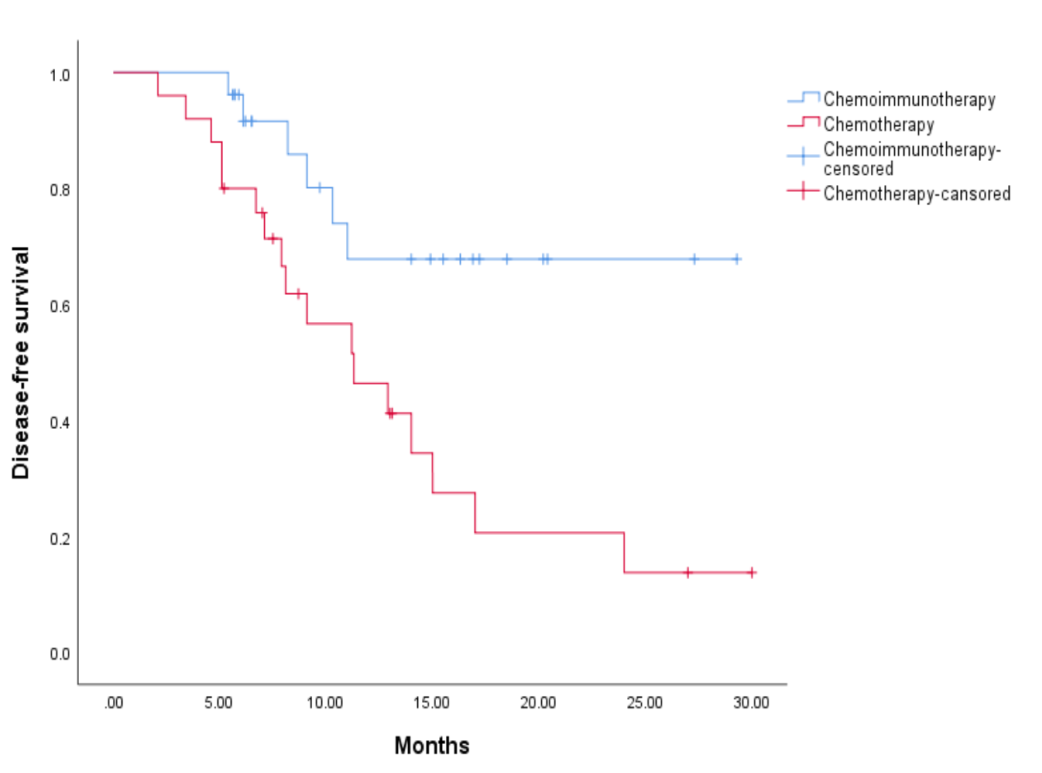
图1 不同新辅助治疗组的无病生存期结果
结论
新辅助免疫检查点抑制剂联合化疗治疗LS-SCLC显示出良好的疗效和可行性,可作为LS-SCLC潜在治疗选择,未来可进一步开展前瞻性随机对照试验证明免疫联合化疗新辅助治疗LS-SCLC的疗效与安全性,以优化LS-SCLC的治疗策略。
【参考文献】
[1] Eskandar A, Ahmed A, Daughtey M, et al. Racial and sex differences in presentation and outcomes of small cell lung cancer in the United States: 1973 to 2010[J].Chest, 2015,147(4): e164-e165.
关于H药 汉斯状®
H药 汉斯状®为重组人源化抗PD-1单抗注射液(通用名:斯鲁利单抗注射液),是全球首个获批一线治疗小细胞肺癌的抗PD-1单抗,已在中国和印度尼西亚获批上市。截至目前,H药已有4项适应症获批上市,2项适应症上市申请分别在中国和欧盟获受理,10余项临床试验同步在全球开展。
2022年3月,H药正式于中国获批上市,目前可用于治疗微卫星高度不稳定(MSI-H)实体瘤、鳞状非小细胞肺癌(sqNSCLC)、广泛期小细胞肺癌(ES-SCLC)及食管鳞状细胞癌(ESCC)。H药联合化疗一线治疗非鳞状非小细胞肺癌(nsNSCLC)和一线治疗广泛期小细胞肺癌(ES-SCLC)的上市申请也分别获得中国NMPA和欧盟EMA受理。聚焦肺癌和消化道肿瘤,复宏汉霖积极推进H药与公司其他产品的协同以及与创新疗法的联合,在全球同步开展10余项肿瘤免疫联合疗法临床试验,于中国、美国、土耳其、波兰、格鲁吉亚等国家和地区累计入组超4000人。H药的4项关键性临床研究结果分别发表于知名期刊《美国医学会杂志》(JAMA)、《自然-医学》(Nature Medicine)、Cancer Cell和British Journal of Cancer。此外,H药还荣获《CSCO 小细胞肺癌诊疗指南》、《CSCO非小细胞肺癌诊疗指南》、《CSCO 食管癌诊疗指南》、《CSCO结直肠癌诊疗指南》、《CSCO免疫检查点抑制剂临床应用指南》和《中国食管癌放射治疗指南》等多部权威指南推荐,为肿瘤临床诊疗提供重要参考。海外方面,H药治疗SCLC也已获得美国FDA和欧盟EC的孤儿药资格认定,并在美国启动了一项H药对比一线标准治疗阿替利珠单抗的头对头桥接试验。
关于复宏汉霖
复宏汉霖(2696.HK)是一家国际化的创新生物制药公司,致力于为全球患者提供可负担的高品质生物药,产品覆盖肿瘤、自身免疫疾病、眼科疾病等领域,已有6款产品在中国获批上市,3款产品在国际获批上市,24项适应症获批,3个上市申请分别获中国药监局和欧盟EMA受理。自2010年成立以来,复宏汉霖已建成一体化生物制药平台,高效及创新的自主核心能力贯穿研发、生产及商业运营全产业链。公司已建立完善高效的全球创新中心,按照国际药品生产质量管理规范(GMP)标准进行生产和质量管控,不断夯实一体化综合生产平台,其中,公司商业化生产基地已相继获得中国、欧盟和美国GMP认证。
复宏汉霖前瞻性布局了一个多元化、高质量的产品管线,涵盖50多个分子,并全面推进基于自有抗PD-1单抗H药汉斯状®的肿瘤免疫联合疗法。截至目前,公司已获批上市产品包括国内首个生物类似药汉利康®(利妥昔单抗)、自主研发的中美欧三地获批单抗生物类似药汉曲优®(曲妥珠单抗,美国商品名:HERCESSI™,欧洲商品名:Zercepac®)、汉达远®(阿达木单抗)、汉贝泰®(贝伐珠单抗)以及汉奈佳®(奈拉替尼),此外,创新产品汉斯状®(斯鲁利单抗)已获批用于治疗微卫星高度不稳定(MSI-H)实体瘤、鳞状非小细胞肺癌、广泛期小细胞肺癌和食管鳞状细胞癌,并成为全球首个获批一线治疗小细胞肺癌的抗PD-1单抗。公司亦同步就16个产品在全球范围内开展30多项临床试验,对外授权全面覆盖欧美主流生物药市场和众多新兴市场。