2025年3月7日,美国旧金山和中国苏州——信达生物制药集团(香港联交所股票代码:01801),一家致力于研发、生产和销售肿瘤、自身免疫、代谢及心血管、眼科等重大疾病领域创新药物的生物制药公司宣布,奥雷巴替尼(商品名:耐立克®)获国家药品监督管理局(NMPA)药品审评中心(CDE)纳入"突破性治疗品种"名单,用于联合化疗一线治疗新诊断费城染色体阳性(Ph+)急性淋巴细胞白血病(ALL)患者。
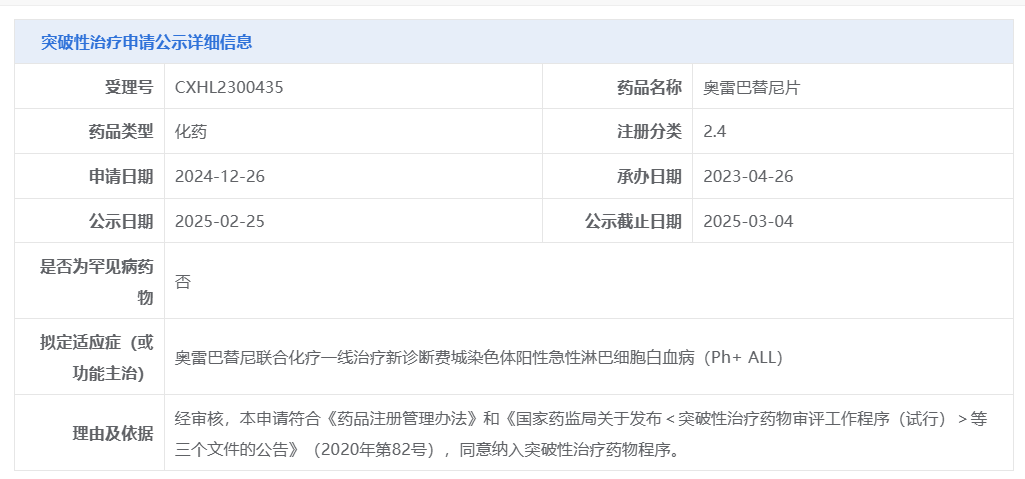
这是耐立克®第三次获CDE纳入突破性治疗品种。此前,该品种分别于2021年3月和2023年6月获纳入突破性治疗品种,用于治疗一代和二代酪氨酸激酶抑制剂(TKI)耐药和/或不耐受的慢性期慢性髓性白血病(CML-CP)患者;及既往经过一线治疗的琥珀酸脱氢酶(succinate dehydrogenase, SDH)缺陷型胃肠道间质瘤(GIST)患者。
突破性治疗品种通常被授予用于防治严重危及生命或者严重影响生存质量的疾病、且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等。对于被纳入突破性治疗品种的药物,CDE将优先配置资源进行沟通交流,加强指导并促进药物研发进程;申请人经评估符合相关条件的,也可以在申请产品上市许可时提出附条件批准申请和优先审评审批申请。总之,突破性治疗品种的审评政策将加快具有重大临床价值、临床急需的创新药或者改良型新药的开发与上市。
急性淋巴细胞白血病(ALL)在中国的发病率约为0.69/10万,Ph+ ALL约占成人ALL患者的20%-30%,且好发于老年人,对治疗耐受性差[1]。在小分子靶向药物TKI问世之前,单纯化疗治疗Ph+ ALL的5年总生存(OS)率低于20%[2]。TKI的应用显著改变了该领域的治疗前景,但一代以及二代TKI治疗Ph+ ALL患者仍存在一定局限性,患者的复发率高、无病生存期短且预后较差。此外,目前国内尚无任何TKI被批准用于一线治疗Ph+ ALL 患者,该领域依然存在较大的、未被满足的临床需求。
耐立克®是中国首个获批上市的第三代BCR-ABL抑制剂。其在中国的商业化推广由亚盛医药和信达生物共同负责。目前,耐立克®已在中国获批的适应症为:治疗任何TKI耐药、并伴有T315I突变的CML慢性期(-CP)和加速期(-AP)的成年患者;以及治疗对一代和二代TKI耐药和/或不耐受的CML-CP成年患者,且所有获批适应症均已被纳入国家医保药品目录。
2023年7月,耐立克®获CDE临床试验许可,开展其联合化疗对比伊马替尼联合化疗治疗新诊断Ph+ ALL患者的全球注册III期临床研究,意味着该药物有望成为国内首个获批用于一线治疗Ph+ ALL的TKI药物。
信达生物制药集团高级副总裁周辉博士表示:“此次奥雷巴替尼被CDE纳入突破性治疗品种,标志着其在Ph+ ALL一线治疗中的重要临床价值获得国家认可。信达生物在血液瘤领域拥有一系列创新产品管线和广阔覆盖的商业化团队,我们将秉持‘开发出老百姓用得起的高质量生物药’的使命,为更广阔的患者及家庭提供更多更优的治疗选择。”
关于耐立克®(奥雷巴替尼)
耐立克®为口服第三代酪氨酸激酶抑制剂(TKI),是中国首个获批上市的第三代BCR-ABL抑制剂,对BCR-ABL以及包括T315I突变在内的多种BCR-ABL突变体有突出效果。
目前,耐立克®已有两项适应症在中国获批并纳入国家医保目录,分别用于治疗T315I突变的慢性髓细胞白血病慢性期(CML-CP)或加速期(-AP)成年患者;以及治疗对一代和二代TKI耐药和/或不耐受的CML-CP成年患者。
2021年7月,信达生物与亚盛医药(6855.HK)达成在中国市场就耐立克®共同开发和共同商业化推广的战略合作。
*注 耐立克®为亚盛医药的注册商标
关于信达生物
“始于信,达于行”,开发出老百姓用得起的高质量生物药,是信达生物的使命和目标。信达生物成立于2011年,致力于研发、生产和销售肿瘤、自身免疫、代谢、眼科等重大疾病领域的创新药物,让我们的工作惠及更多的生命。公司已有14个产品获得批准上市,它们分别是信迪利单抗注射液(达伯舒®),贝伐珠单抗注射液(达攸同®),阿达木单抗注射液(苏立信®),利妥昔单抗注射液(达伯华®),佩米替尼片(达伯坦®),奥雷巴替尼片(耐立克®), 雷莫西尤单抗注射液(希冉择®),塞普替尼胶囊(睿妥®),伊基奥仑赛注射液(福可苏®),托莱西单抗注射液(信必乐®), 氟泽雷塞片(达伯特®),匹妥布替尼片(捷帕力®),己二酸他雷替尼胶囊(达伯乐®)和利厄替尼片(奥壹新®)。目前,同时还有4个品种在NMPA审评中,2个新药分子进入III期或关键性临床研究,另外还有17个新药品种已进入临床研究。
公司已与礼来、罗氏、赛诺菲、Adimab、Incyte和MD Anderson 癌症中心等国际合作方达成30多项战略合作。信达生物在不断自研创新药物、谋求自身发展的同时,秉承经济建设以人民为中心的发展思想。多年来,始终心怀科学善念,坚守“以患者为中心”,心系患者并关注患者家庭,积极履行社会责任。公司陆续发起、参与了多项药品公益援助项目,让越来越多的患者能够得益于生命科学的进步,买得到、用得起高质量的生物药。截至目前,信达生物患者援助项目已惠及20余万普通患者,药物捐赠总价值36亿元人民币。信达生物希望和大家一起努力,提高中国生物制药产业的发展水平,以满足百姓用药可及性和人民对生命健康美好愿望的追求。
声明:
1.信达生物不推荐未获批的药品/适应症的使用。
2.雷莫西尤单抗注射液(希冉择®)、塞普替尼胶囊(睿妥®)和匹妥布替尼片(捷帕力®)由礼来公司研发 。
参考文献
1.Theresa Liu-Dumlao, Hagop Kantarjian, et al. Philadelphia-positive acute lymphoblastic leukemia: current treatment options. Curr Oncol Rep. 2012 Oct;14(5):387-94.
2.Abou Dalle I et. Treatment of Philadelphia Chromosome-Positive Acute Lymphoblastic Leukemia. Curr Treat Options Oncol2019 Jan 24;20(1):4.