2025年6月4日,美国旧金山和中国苏州——信达生物制药集团(香港联交所股票代码:01801),一家致力于研发、生产和销售肿瘤、心血管及代谢、自身免疫、眼科等重大疾病领域创新药物的生物制药公司,在2025年美国临床肿瘤学会(ASCO)年会上口头报告了全球首创(First-in-class)PD-1/IL-2α-bias双特异性抗体融合蛋白IBI363治疗晚期非小细胞肺癌的临床I期研究数据,这也是继结直肠癌和黑色素瘤之后IBI363今年ASCO大会的第三项口头报告。在免疫治疗耐药的鳞状非小细胞肺癌和野生型肺腺癌中,都观察到了可控的安全性、令人鼓舞的疗效及长期生存获益趋势。值得一提的是,信达生物肿瘤管线在此次ASCO会议上共有8项口头报告,约占大会口头报告总数的2%。
目前,信达生物正在中国、美国、澳大利亚同时开展临床研究,探索 IBI363 在免疫耐药、冷肿瘤和前线治疗等多瘤种适应症的有效性和安全性。本次ASCO会议,IBI363在首批探索的非小细胞肺癌、结直肠癌、黑色素瘤三项免疫耐药及冷肿瘤中,均以口头报告形式报道了令人鼓舞的I/II期临床数据,从肿瘤响应到长期生存获益,全面地展现了IBI363在各适应症的突破性临床研究结果。这是IBI363从创新药物机理到临床转化的扎实验证,并提示其进一步拓展临床开发的潜力,有望为免疫治疗空白的领域带来新希望。
PD-1/IL-2α-bias双特异性抗体融合蛋白(IBI363)在经免疫治疗耐药的晚期非小细胞肺癌的I期临床数据
本次大会报道了IBI363单药用于晚期非小细胞肺癌受试者的更新数据(研究登记号:NCT05460767)。截止随访时间2025年4月7日,共136例非小细胞肺癌受试者接受了IBI363单药治疗(2 μg/kg QW~4mg/kg Q3W),其中包括67例鳞状非小细胞癌和58例EGFR野生型腺癌。
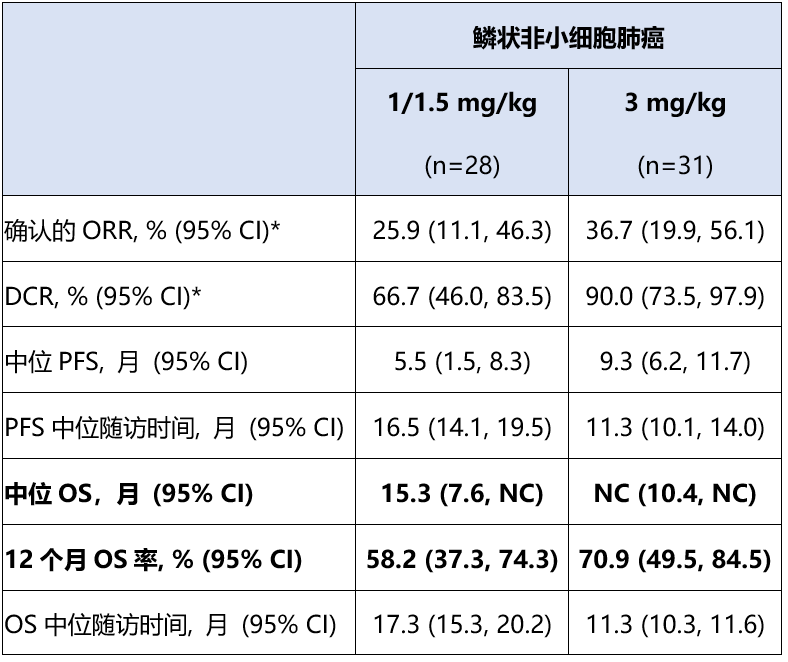
IBI363在免疫耐药的鳞状非小细胞肺癌中,从肿瘤响应到长期生存获益,展现出突破性的治疗潜力
67例鳞状非小细胞肺癌均无已知的EGFR突变,其中28例接受了1 mg/kg Q2W或1.5 mg/kg Q3W IBI363治疗,31例接受了3 mg/kg Q3W IBI363治疗。两组受试者既往系统性治疗线数≥2线的比例为64.3% (18/28) vs 67.7% (21/31),既往抗PD-1/PD-L1治疗的比例为100% (28/28) vs 96.8% (30/31),PD-L1 TPS<1%的比例为35.7% (10/28) vs 41.9% (13/31)。
在1/1.5 mg/kg剂量组,IBI363取得了优异的ORR、DCR、PFS、OS数据,中位OS达15.3个月,提示IBI363通过“ PD-1靶向+IL-2激活扩增肿瘤特异性T细胞”的免疫检查点阻断+细胞因子激动双重作用,带来潜在长期生存获益。
相较于1/1.5 mg/kg剂量组,3 mg/kg Q3W剂量组观察到更突出的确认的ORR(36.7%)、DCR(90.0%)、PFS(中位PFS 9.3个月)及OS趋势(中位OS未达到、12个月OS率70.9%)(详见下表)。
*注:在1/1.5mg/kg 和3mg/kg剂量组各有1例患者已结束药物治疗,但未接受过基线后肿瘤评估。
在PD-L1 TPS<1%的受试者中,IBI363展现出突出的疗效信号:1/1.5 mg/kg组(N=10)的确认的ORR为30.0%、DCR为90.0%,3 mg/kg组(N=13)的确认的ORR为46.2%、DCR为92.3%,提示IBI363在PD-L1低表达人群中的潜在优势。
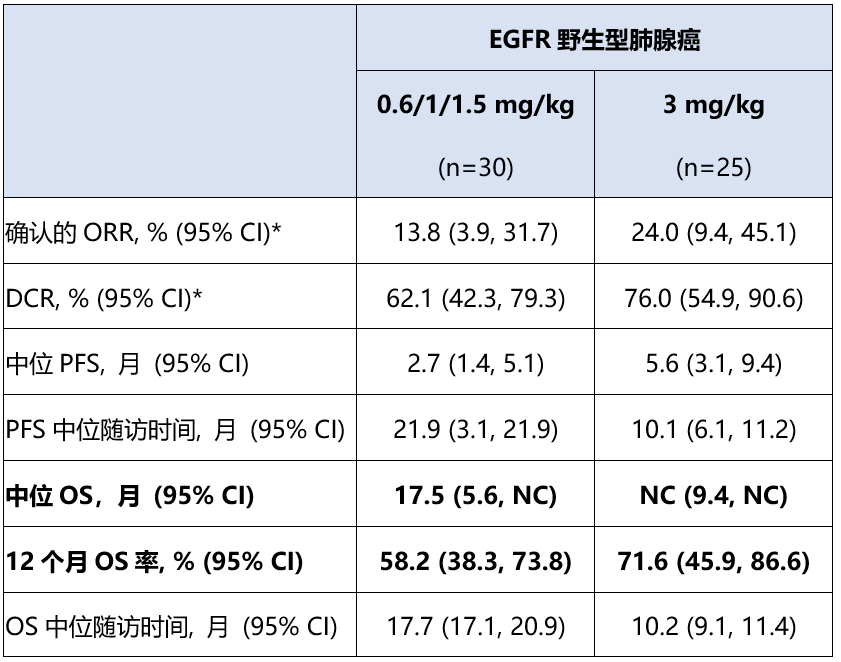
IBI363在免疫耐药的野生型肺腺癌中展现出长期生存获益潜力,尤其在有吸烟史受试者中疗效尤为突出
58例EGFR野生型肺腺癌中,30例接受了0.6 mg/kg Q2W或1 mg/kg Q2W或1.5 mg/kg Q3W IBI363治疗,25例接受了3 mg/kg Q3W IBI363治疗。两组受试者既往系统性治疗线数≥2线的比例为80.0% (24/30) vs 64.0% (16/25),既往抗PD-1/PD-L1治疗的比例均为100%,PD-L1 TPS<1%的比例为26.7% (8/30) vs 40.0% (10/25),吸烟史比例为56.7% (17/30) vs 60.0% (15/25)。
在0.6/1/1.5 mg/kg剂量组,中位OS达17.5个月,同样提示IBI363通过“ PD-1靶向+IL-2激活扩增肿瘤特异性T细胞”的免疫检查点阻断+细胞因子激动双重作用,带来潜在长期生存获益。
相较于0.6/1/1.5 mg/kg剂量组,3 mg/kg剂量组观察到更高的确认的ORR(24.0%)、DCR(76.0%)、PFS(中位PFS 5.6个月)及OS趋势(中位OS未达到、12个月OS率71.6%)(详见下表)。
*注:在0.6/1/1.5mg/kg 有1例患者已结束药物治疗,但未接受过基线后肿瘤评估。
在有吸烟史的肺腺癌受试者中,观察到更高的ORR,PFS和OS获益。其中,0.6/1/1.5 mg/kg组(N=17)确认的ORR为23.5%,3 mg/kg组(N=15)确认的ORR为33.3%。所有剂量组吸烟者(N=32)相较非吸烟者(N=23)的中位PFS更长:达5.3 vs 3.0 个月。长期生存获益方面,随访12.0个月和13.7个月后,非吸烟者中位OS 为13.6个月,而吸烟者中位OS仍未达到,仅9(28.1%)例发生事件。
IBI363在非小细胞肺癌中安全性可控
在3 mg/kg剂量组的57例非小细胞肺癌受试者中,最常见的3级或以上的治疗相关不良事件(TRAE)是关节痛和皮疹,7.0%的受试者发生了导致永久停药的TRAE,安全性整体可控。
鉴于IBI363单药展示出的令人鼓舞的疗效信号及可控的安全性,信达生物计划在经含铂化疗及抗PD-1/PD-L1免疫治疗失败的局部晚期或转移性鳞状非小细胞肺癌中率先开展III期注册临床研究。截至目前,IBI363在鳞状非小细胞肺癌已经获得中国CDE突破性治疗药物(BTD)认证和美国FDA快速通道资格(FTD)认定。
浙江大学医学院附属第一医院周建娅教授表示:“肺癌是全球及中国发病率和死亡率最高的恶性肿瘤1,是危害公共健康的重大问题。尽管免疫治疗已经彻底改变了非小细胞肺癌的治疗格局,但对于免疫治疗失败的野生型非小细胞肺癌患者,当前标准治疗方案多西他赛疗效有限,ORR不到20%,PFS不到4个月,OS不到12个月2-7。近年来,虽然免疫联合治疗、抗体偶联药物(ADCs)等新型治疗方案的探索带来了新的希望,但多项针对含铂化疗及免疫治疗失败的非小细胞肺癌人群的大型III期临床研究均未获得令人满意的结果,其中多数研究未达到主要终点2-6。TROPION-Lung01研究虽然在NSCLC中达到PFS主要终点,然并未达到OS主要终点。尤其在鳞状非小细胞肺癌中,试验组的PFS/OS/ORR均未见提升7。因此,在免疫治疗失败的非小细胞肺癌中,存在巨大且迫切的未满足的临床需求。IBI363作为PD-1/IL-2α-bias双特异性分子,在免疫耐药的非小细胞肺癌中,不仅在ORR和PFS上都显示出临床获益,更让我们看到了相较于化疗,免疫治疗的拖尾效应为患者带来长期生存获益的潜力。我们也更为期待IBI363高剂量组长期随访的生存数据。”
信达生物制药集团高级副总裁周辉博士表示:“很高兴在ASCO大会口头汇报IBI363在肺癌领域的最新进展。IBI363在免疫耐药的野生型非小细胞肺癌中疗效突出,且临床数据显示在更高的剂量下展现出更好的ORR、DCR、PFS及OS趋势的潜力。我们期待更长期的随访带来更成熟的数据,期望看到其作为免疫疗法对于患者长期生存获益的潜力。同时,无论PD-L1表达水平高低,IBI363在免疫耐药的非小细胞肺癌(尤其是鳞状非小细胞肺癌)中,均展现了强大的抗肿瘤作用,提示IBI363的作用不依赖于PD-L1表达,未来在PD-L1低表达甚至不表达的冷肿瘤中,也可能带来突破。我们将持续推进IBI363在非小细胞肺癌和其他瘤种的临床探索。”
关于IBI363(PD-1/IL-2α-bias双特异性抗体融合蛋白)
IBI363是由信达生物自主研发的全球首创PD-1/IL-2α-bias双特异性融合蛋白,同时具有阻断PD-1/PD-L1通路和激活IL-2通路两项功能。IBI363的IL-2臂经过了设计改造,保留了其对IL-2 Rα的亲和力,但削弱了对IL-2Rβ和IL-2Rγ的结合能力,以此降低毒性;而PD-1结合臂可以同时实现对PD-1的阻断和IL-2的选择性递送。由于新激活的肿瘤特异性T细胞同时表达PD-1和IL-2α,这一差异性策略可以更精确和有效地实现对该T细胞亚群的靶向和激活。IBI363不仅在多种荷瘤药理学模型中展现出了良好抗肿瘤活性,在PD-1耐药和转移模型中也表现出了突出的抑瘤效力。
从临床迫切需求出发,信达生物正在中国、美国、澳大利亚开展临床研究探索IBI363在针对各种恶性肿瘤的有效性和安全性。IBI363已开出首个关键注册临床研究,用于治疗未经免疫治疗的粘膜型和肢端型黑色素瘤。
IBI363已获美国FDA两项快速通道资格认定,分别用于治疗晚期鳞状非小细胞肺癌和黑色素瘤。IBI363也获得中国NMPA纳入两项突破性疗法认证,治疗晚期黑色素瘤和鳞状非小细胞肺癌。
关于信达生物
“始于信,达于行”,开发出老百姓用得起的高质量生物药,是信达生物的使命和目标。信达生物成立于2011年,致力于研发、生产和销售肿瘤、自身免疫、代谢、眼科等重大疾病领域的创新药物,让我们的工作惠及更多的生命。公司已有15个产品获得批准上市,它们分别是信迪利单抗注射液(达伯舒®),贝伐珠单抗注射液(达攸同®),阿达木单抗注射液(苏立信®),利妥昔单抗注射液(达伯华®),佩米替尼片(达伯坦®),奥雷巴替尼片(耐立克®), 雷莫西尤单抗注射液(希冉择®),塞普替尼胶囊(睿妥®),伊基奥仑赛注射液(福可苏®),托莱西单抗注射液(信必乐®),氟泽雷塞片(达伯特®),匹妥布替尼片(捷帕力®),己二酸他雷替尼胶囊(达伯乐®),利厄替尼片(奥壹新®)和替妥尤单抗N01注射液(信必敏®)。目前,同时还有3个品种在NMPA审评中,4个新药分子进入III期或关键性临床研究,另外还有15个新药品种已进入临床研究。
公司已与礼来、罗氏、赛诺菲、Incyte和MD Anderson 癌症中心等国际合作方达成30多项战略合作。信达生物在不断自研创新药物、谋求自身发展的同时,秉承经济建设以人民为中心的发展思想。多年来,始终心怀科学善念,坚守“以患者为中心”,心系患者并关注患者家庭,积极履行社会责任。公司陆续发起、参与了多项药品公益援助项目,让越来越多的患者能够得益于生命科学的进步,买得到、用得起高质量的生物药。截至目前,信达生物患者援助项目已惠及20余万普通患者,药物捐赠总价值36亿元人民币。信达生物希望和大家一起努力,提高中国生物制药产业的发展水平,以满足百姓用药可及性和人民对生命健康美好愿望的追求。
声明:
1.信达不推荐任何未获批的药品/适应症使用。
2.雷莫西尤单抗注射液(希冉择®),塞普替尼胶囊(睿妥®)和匹妥布替尼片(捷帕力®)由礼来公司研发。