•受美国影响,日本于1985年开始导入临床试验伦理委员会(IRB)应在每家研究机构分别设立制度,即1990年10月施行的旧GCP明确规定IRB原则上应在每家研究机构分别设立,直至2008年3月GCP省令修订才被废除该规定。然而此后IRB中心化并未推进,目前日本仍有约1300个临床试验IRB,中心IRB在许多研究机构普及程度不充分。
•在IRB中心化方面欧美与日本存在差异。欧盟采用去机构化的中心IRB审查体制,遵循“一个成员国,一个意见”原则;美国正加速向商业IRB高度集中方向发展;而日本的IRB中心化进展缓慢。
•为解决“药品错失和药品上市延迟”问题,日本正加速临床试验IRB的变革,不仅推动中心IRB,更向单一IRB迈进。
撰文|医药研发达人主编 高野哲臣(t2T Healthcare股份公司总裁兼首席执行官)
翻译|项安波(石药集团) 董方(东方伊诺医疗科技)
中文版翻译负责人|医药研发达人主编 高野哲臣
2025年6月13日出版,医药研发达人中文版“出海日本”第11期,系列A《日本的临床试验和药品市场》第五篇
本系列A《日本的临床试验与药品市场》第五篇,由高野向大家介绍日本的IRB的历史背景、发展过程、现状,以及正在发生的变革与未来走向。
需要注意的是,本文多处亦包含笔者的主观看法,敬请读者留意。
日本临床试验IRB的历史
全球各国的伦理委员会(IRB)之起源可以追溯到20世纪60年代的美国。在美国构想IRB制度时,临床研究大多在单一的研究机构内进行。1974年,美国制定的《国家研究法》(National Research Act)规定,接受联邦资助的研究机构必须设立“机构内部审查委员会(Institutional Review Board,IRB)”,对临床研究计划进行事前审查。(来源:田代志门《医疗与社会》28卷1期,第79-91页,2018年等)
日本关于药物临床试验实施的标准(旧GCP)于1985年12月公布草案,随后于1989年10月作为厚生省药务局局长通知正式公布,并于一年后的1990年10月开始实施。该旧版GCP沿用了“Institutional(机构内)”的概念,明确规定IRB原则上应在每家研究机构分别设立。
随后,在1996年5月,ICH-GCP达成共识并进入第4阶段,其并未规定各研究机构必须单独设立IRB。
为了落实ICH-GCP的要求,日本于1997年3月公布了对应的GCP省令(新GCP),并于1998年4月全面实施。然而,尽管该GCP省令基本上反映了ICH-GCP的内容,但由于是在延续1990年10月施行的局长通知(旧GCP)的基础上制定的,因此仍明确规定每家研究机构原则上必须设立IRB。
这一原则性规定,直到GCP省令公布11年后的2008年3月GCP省令修订时才被废除。根据PMDA公开信息(https://www.pmda.go.jp/review-services/trials/0008.html),截至2025年4月30日,日本依然存在约1,300个临床试验IRB。这表明,即使在2008年3月以后,日本的IRB数量并未出现明显减少。笔者认为,在2008年3月以前就已设立院内IRB的医疗机构,向“废除院内IRB → 使用院外IRB”方向转变的趋势依旧缓慢。(参见第8期图1)
欧美临床试验呈现IRB中心化趋势
在欧洲,伦理委员会(IRB)多数被定位为公立机构,数量相对较少。例如,法国有39个IRB,英国为87个。相较于历史上由各研究机构自行设立IRB的美国与日本,欧洲的IRB数量显著偏少。此外,在各欧盟成员国中,只要获得该国某一家IRB批准和其监管部门许可,即可启动临床试验。
此外,欧洲在《临床试验指令》(Clinical Trials Directive 2001/20/EC)中还明确规定了“一个成员国,一个意见”的原则。也就是说,欧洲去机构化的中心审查体制已成为基本前提。此后,该指令由《临床试验条例》(Clinical Trials Regulation (EU) No 536/2014,于2022年1月底生效)所取代。尽管在《临床试验条例》中对IRB相关规定进行了若干重要修改,但“一个成员国,一个意见”的基本原则仍然得以保留。
另一方面,为了在美国推进中心IRB(Central IRB),FDA于2006年3月发布了《行业指导原则:在多中心临床试验中使用中心IRB审查流程》(Guidance for Industry: Using a Centralized IRB Review Process in Multicenter Clinical Trials)。不过,其不具法律约束力,仅作为推荐性意见。此外,美国国立卫生研究院(NIH)于2016年发布了指南,要求由NIH资助的临床试验必须采用单一IRB(Single IRB)进行审查。
截至2023年,美国约有2,300个IRB分布在1,800家研究机构或组织中。其中,大学IRB占比过半(1,284个,占56%),其次为研究机构(553个,24%)、民间组织(229个,10%)、政府机构(190个,8%)以及独立IRB(47个,2%)。
在美国,受FDA监管的IND临床试验(每年约2,000项左右)中,由独立IRB(包括非营利IRB及商业IRB)进行审查的占比,从2012年的25%上升至2021年的48%,首次超过大学IRB跃居首位。值得注意的是,独立IRB的数量本身因整合而有所减少,目前呈现由两家商业IRB(WCG公司与Advarra公司)寡头垄断的格局, 2021年的IND临床试验中,仅这2家公司承担的IRB审查数就占了独立IRB的92%。这两家公司的IRB会议皆为每日召开,IRB委员人数超过150人。据称,WCG公司2020年仅IRB相关业务与咨询服务的毛利润就分别超过1亿美元。
(本章节资料来源:2023年5月《国内外临床试验相关环境最新动向调查研究》,令和4年度 总括·分担研究报告书,佐藤晓洋等;2024年3月21日《第九届加强药品研发能力和确保稳定供应的监管研讨会》资料3)
尚未推进中心化的日本临床试验IRB
如前所述,在欧洲,IRB自设立之初即为中心化体系,并已在现行法律框架下,仅由公立中心IRB负责运营。而美国虽最初以研究机构IRB为主,但自2020年前后迅速推进中心化,目前正加速向商业IRB高度集中的方向发展。
然而,在日本,虽然在2008年3月通过修订GCP省令,废除了每家研究机构必须设立IRB的原则性义务,但其后IRB的中心化并未显著推进。尽管在部分诊所及国立医院机构中,中心IRB的使用已有所发展,但在大学附属医院及公立医院等研究机构中,中心IRB的普及程度仍不充分。
需要指出的是,中心IRB所具备的优点,其实正是解决了各研究机构分别设立IRB所存在的不利之处:如在申报前各研究机构需进行大量准备工作及等待排队审查,部分研究机构导致IRB批准可能耗时数月;且各IRB对申请资料的要求不尽相同,给申办者(包括CRO)带来较大负担;最终导致临床试验启动周期延长,研究机构与申办者双方的行政工作量剧增,进而抬高成本;此外,在IRB审查的一贯性与质量保障方面也存在一定担忧。
为了解决自2022年左右以来在日本凸显的“药品错失和药品上市延迟”问题,日本厚生劳动省(MHLW)于2023年7月至2024年3月设置了《加强药品研发能力和确保稳定供应的监管研讨会》(监管研讨会),并于2024年4月形成了报告。关于包括中心IRB推广在内的临床试验效率提升(即引入“临床试验生态系统”)议题,在2024年3月21日举行的第九届监管研讨会中进行了重点讨论(参见图1)。
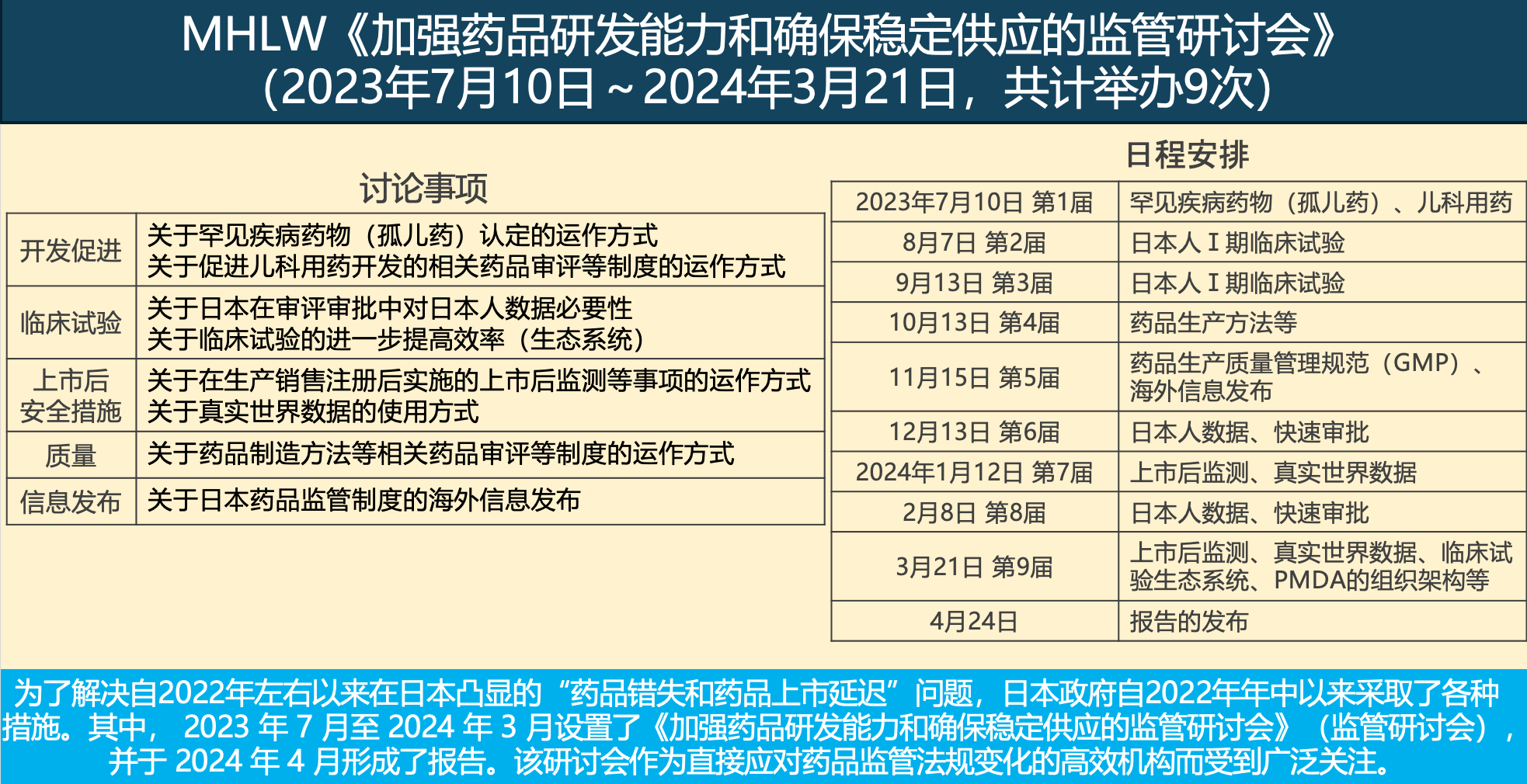
图1. MHLW《加强药品研发能力和确保稳定供应的监管研讨会》(2023年7月10日~2024年3月21日,共计举办9次)
(引自关西药品协会,MHLW吉田易范大臣官房审议官特别演讲会,大阪,2024年5月29日,部分改编)
在第九届监管研讨会上,有专家指出,在日本中心IRB普及不力的原因在于,研究机构难以享受到中心IRB带来的好处,反而面临更多弊端(见图2)。笔者认为,图2中所列的诸多原因,与中国的中心IRB未能普及的原因存在高度共性。

图2. 日本中心IRB未能普及的原因(引自: MHLW第九届《加强药品研发能力和确保稳定供应的监管研讨会》,资料3,东京,2024年3月21日)
并非止步于中心化,日本临床试验IRB正加速迈向单一IRB
由于中心IRB具备减轻事务工作量、降低成本、加快临床试验启动速度、确保审查一贯性与质量等多重优势,第九届监管研讨会结论提出了鼓励采用中心IRB的方针,且“原则上应由中心IRB进行审查”这一点将以书面形式加以明确。目前,MHLW、药品医疗器械综合机构(PMDA)以及制药界正听取医疗相关人士的意见,推进相关文件的制定与发布工作。
特别值得关注的是,由内阁官房健康·医疗战略室负责雜務工作的“提升药品研发能力,将最新药品快速送达国民的构想会议”在2024年5月22日公布的中期总结中,提出了要在日本的多中心临床试验中,将中心IRB的最终进化形态——“每项试验方案(Protocol)仅由单一IRB审查(Single IRB)”作为原则,并致力于解决实施该原则所面临的制度与流程障碍。从2024年开始,日本在临床试验IRB的制度改革上,将不仅仅是推动中心IRB,而是直接向单一IRB迈出关键一步。
笔者注释:
单一IRB (Single IRB)是中心IRB模式中最理想且最高效的形式,即单一IRB的定义与中心IRB(Central IRB)有所不同。例如,在日本部分诊所及国立医院机构中,中心IRB的使用已有所发展,这有助于减少整个临床试验中的IRB数量,但尚未开始建立全国单一IRB。也就是说,日本与欧洲的情况不同。另一方面,中国的状况与日本相似,虽然各市和省可能设有中心IRB,但并非覆盖中国所有研究机构的"单一IRB(按单一试验方案)",尚未建立参与全国的多中心试验或MRCT的全国单一IRB。(高野哲臣)
作为这一趋势的佐证,目前MHLW正在讨论的《2025年GCP省令等的主要修订内容》中,“单一IRB原则化”已被列为首要议题(见图3)。

图3. 2025年 J-GCP (GCP省令) 等的主要修订内容(正在讨论中的草案)
(引自:MHLW审评管理课,2024年度临床试验生态系统导入推进事业成果报告会,东京,2025年3月24日,部分改编)
目前,ICH-GCP(E6)正在进行全面修订,其最新版本E6(R3)的原则(Principles)及附件1(Annex 1)已于2025年1月6日达到第4阶段,而E6(R3)的附件2(Annex 2)也已于2024年11月至2025年3月进行公开征求意见。
为反映E6(R3)内容,J-GCP(GCP省令)预计将在2025 - 2026年左右进行全面修订。届时,将利用此次修订机会,针对IRB,除推进上述单一IRB外,还期望推进接受英文资料、通过整理IRB审议事项等实现程序合理化、提高审查效率、推进临床试验电子化与数字化转型(DX)、集约化与高效化处理事务性工作,以及随之带来的研究机构和临床试验申办者双方的成本削减等内容。
通过IRB的集约化,不仅可以加快临床试验启动速度、提高效率,还能够提供适应复杂化、多样化临床试验的高质量审查功能。这些正是近年来日本临床试验申办者对IRB系统的核心期待——如今,这些愿景正逐步成为现实。
综上所述,本文回顾了“日本的临床试验IRB”从历史沿革、现状分析到未来制度改革的全貌。可以明确预见的是:2025至2026年,日本的临床试验IRB体系将发生重大变革。
下一篇(系列A第六篇)将介绍:关于“日本药品监管部门应对药品错失和药品上市延迟的措施示例”中的“日本临床试验费用的计算方法的合理化与透明化——引入基于公平市场价值(Fair Market Value)的基准型成本计算机制”等内容(参见第3期图4之第6项内容)。敬请期待。
预告
下期(第12期)预计于2025年6月下旬出版,内容为东内祥浩先生撰写的系列B《日本的监管制度及其实际情况》中的第五篇,主题为《日本的临床试验申报》。高野哲臣先生撰写的系列A《日本的临床试验和药品市场》第六篇《日本的临床试验费用计算方法》预计将于2025年7月上旬出版。
中文版第11期作者简介

高野哲臣(Tetsuomi Takano)
t2T Healthcare Inc.的创始人、总裁兼首席执行官
高野哲臣拥有超过32年的临床开发经验,涉猎多个治疗领域,并在日本、中国、韩国、中国台湾等亚洲国家和地区积累了深厚的开发战略、项目管理、临床开发、法规情报及法规事务经验。曾在安斯泰来制药临床开发部门担任要职,负责从首次人体试验(IND)提交到亚洲国家和地区新药申请(NDA)的批准工作。
高野哲臣与亚洲各国和地区的意见领袖建立了广泛联系,热衷于参与行业活动,曾担任日本制药工业协会(JPMA)国际委员会亚洲部会副主席、日本药品医疗器械综合机构(PMDA)举行的APEC卓越中心MRCT研讨会项目委员会成员及演讲者、红龙会研讨会联合创始人及常驻演讲者等多重角色。
此外,他还是PMDA中国专家委员会的成员,并联合创立了《医薬研発達人 医药研发达人》杂志,担任主编及主要撰稿人。
高级日语译者简介
本专栏特邀多名在日本留学、工作多年,拥有丰富经验的学者精准翻译,旨在准确传达作者原意,帮助国内读者更好了解日本的监管理念及产业发展趋势。

项安波博士
石药集团临床事业部总裁兼首席医学官(非肿瘤)
项博士为日本筑波大学医学博士,曾在GSK(日本)公司从事新药研发工作长达14年,期间荣获GSK R&D’s Exceptional Science Award Program奖项,拥有11年中国执业医师经验及逾25年在中日两国创新药临床开发的实践经验。

董方
东方伊诺(苏州)医疗科技有限公司创始人、董事长兼CEO
董方为日本国立筑波大学大学院硕士,日本化学药品株式会社临床诊断试剂事业部GMP技术总监。20多年留日经验。免疫检测方法学专家,国家“十二五”863课题负责人,深耕阿尔茨海默病和过敏原快速定量检测相关诊断产品的开发和生产,并具有全流程经验,苏州高新区领军人才,苏州市过敏防治研究会理事。
致谢
我们衷心感谢中国医药创新促进会、上海市生物医药科技产业促进中心、泰格医药作为本栏目联合主办单位,并给予我们宝贵的建议和支持。
第1期(系列A-1):医药研发达人中文版“出海日本”首期:日本临床试验的历史(上)
第2期(系列B-1):日本药监部门的全面介绍|医药研发达人中文版“出海日本”第2期
第3期(系列A-2):ICH E17实施后两级分化的东亚临床试验格局|日本临床试验的历史(下)
第4期(系列C-1):宇山佳明:PMDA监管科学的灵魂人物
第5期(系列B-2):聚焦日本药品监管法规:药事法、药械法
第6期(系列A-3):日本独有的临床试验信息登记网站挑战
第7期(系列B-3):终于出来了!PMDA咨询深度指南
第8期(系列A-4):日本的J-GCP与ICH-GCP有什么区别?ICF有哪些日本特色?
第9期(系列C-2):中村健一:日本国立癌症研究中心如何改变亚洲临床试验格局
编辑 | 毛冬蕾
mao.donglei@PharmaDJ.com
编辑 | 高野哲臣
t2.takano@outlook.com
访问研发客网站,深度报道和每日新闻抢鲜看
