近日,由北京协和医院冯凤芝教授牵头开展的一项低剂量仑伐替尼联合特瑞普利单抗用于既往接受过多线治疗的卵巢癌的多中心II期临床研究的阶段性成果发表在国际妇科肿瘤学权威期刊《Gynecologic Oncology》,引发广泛关注。该研究是首个前瞻性探索剂量优化策略下的仑伐替尼联合抗PD-1单抗(特瑞普利单抗)治疗复发性铂耐药卵巢癌(PROC)的临床研究。初步数据已显示,这一剂量优化的联合治疗策略在PROC患者中展现出令人鼓舞的疗效的同时,兼具更好的安全性与耐受性,有望为卵巢癌患者精准治疗提供全新策略。
北京协和医院的冯凤芝教授和大连医科大学附属第二医院的蒋葵教授为本文的共同通讯作者,本文第一作者为北京协和医院的苏昊和商晓医生。
【要点速览】
-
铂耐药卵巢癌预后极差,治疗选择有限,亟需创新疗法;
-
多中心II期研究初步证实,低剂量仑伐替尼联合特瑞普利单抗治疗PROC疗效可喜,客观缓解率(ORR)为27%,中位缓解持续时间(DoR)为4.4个月;中位无进展生存(PFS)达5.0个月,中位总生存期(OS)达13.3个月;
-
该方案安全性可控,39%的患者发生3级治疗相关不良事件(TRAE),无4-5级TRAE发生。

期刊发表原文(图片来源:期刊官网)
研究背景
卵巢癌作为全球女性第八大常见恶性肿瘤,致死率极高。尽管患者对以铂类为基础的化疗初始反应积极,但大多数会经历多次复发,并最终进展为铂耐药。铂耐药卵巢癌患者预后极差,且后续治疗选择有限,临床上亟需安全有效的新型治疗策略。
既往仑伐替尼联合抗PD-1单抗在多种实体瘤中已展现出显著的抗肿瘤活性。然而,多项妇科肿瘤临床试验中,仑伐替尼20mg标准剂量常伴随严重药物不良事件,导致部分患者治疗中断,可能影响整体疗效。既往研究表明,通过调整仑伐替尼剂量,有望在维持甚至提升疗效的同时,显著改善患者的耐受性。鉴于铂耐药卵巢癌患者对低毒高效疗法的迫切需求,研究者开展了该项临床研究以探索低剂量仑伐替尼与国产抗PD-1单抗特瑞普利单抗联合方案的治疗潜力。该研究仍在继续入组和随访中,目前报告研究的初步结果。
研究设计
该研究是一项正在进行的前瞻性、开放标签、单臂、II期临床研究(NCT06241105),纳入组织学或细胞学确诊的铂耐药(最近一次以铂类为基础的化疗期间或化疗后6个月内出现疾病进展)复发性卵巢上皮癌、输卵管癌、原发性腹膜癌患者,旨在评估低剂量仑伐替尼联合特瑞普利单抗治疗的疗效和安全性。入组患者接受低剂量仑伐替尼(起始剂量8mg/天;治疗4周后,体重不足60kg的患者继续接受8mg剂量,体重超过60kg的患者因耐受性良好调整为12mg)和特瑞普利单抗(240mg,Q3W)治疗,直至疾病进展或不可耐受毒性或患者自愿退出。主要终点为研究者根据RECIST V1.1或GCIG CA125标准评估的PFS,次要终点包括ORR、DoR、疾病控制率(DCR)、OS及安全性。
研究结果
截至2025年3月31日,共入组33例患者,中位年龄为57岁。所有患者均接受过全身治疗,中位治疗线数为3线,其中11例(33%)患者既往接受过4线及以上全身治疗。12例(36%)患者的无铂治疗间期(PFI,定义为末次铂类化疗与疾病进展之间的时间间隔)不足3个月,21例(64%)患者的无铂间期为3-6个月。入组患者中91%(30例)为铂耐药,9%(3例)为原发性铂难治。自首次给药至数据截止日的中位时间为18.2个月(范围8.3–26.3个月)。
-
初步结果令人振奋,客观缓解率为27%
33例患者中,9例(27%)患者实现部分缓解(PR),ORR为27%(95%CI:13%-46%),疾病控制率(DCR)为54%(95%CI:36%-72%)。在至少进行过一次基线后影像学肿瘤评估的患者(28例)中,17例(52%)患者的靶病灶较基线缩小(图1)。中位DoR为4.4个月(范围2.1-≥17.4),2例患者在数据截止时仍在接受治疗中(图2)。
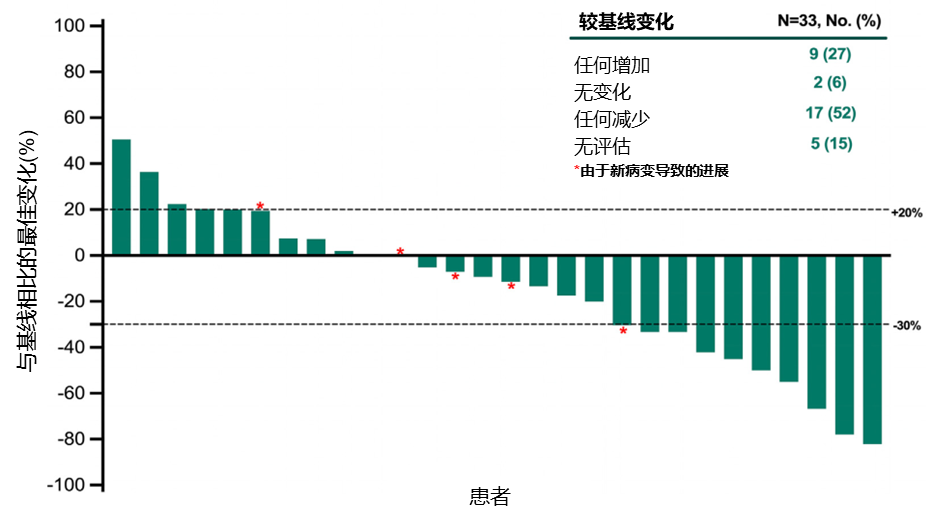
图1.靶病灶较基线的最佳变化
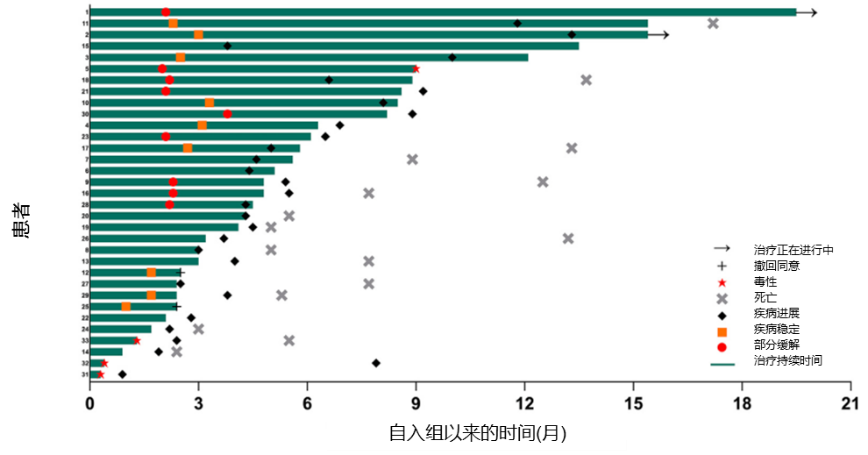
图2.所有患者的治疗持续时间及疗效评估情况
-
生存获益显现,中位OS为13.3个月
截至数据截止日,29例(88%)患者发生PFS事件。中位PFS为5.0个月(95%CI:3.8-6.2),6个月和12个月PFS率分别为42%和12%(图3)。中位OS为13.3个月(95%CI:12.4-14.2),6个月和12个月的OS率分别为78%和65%(图4)。
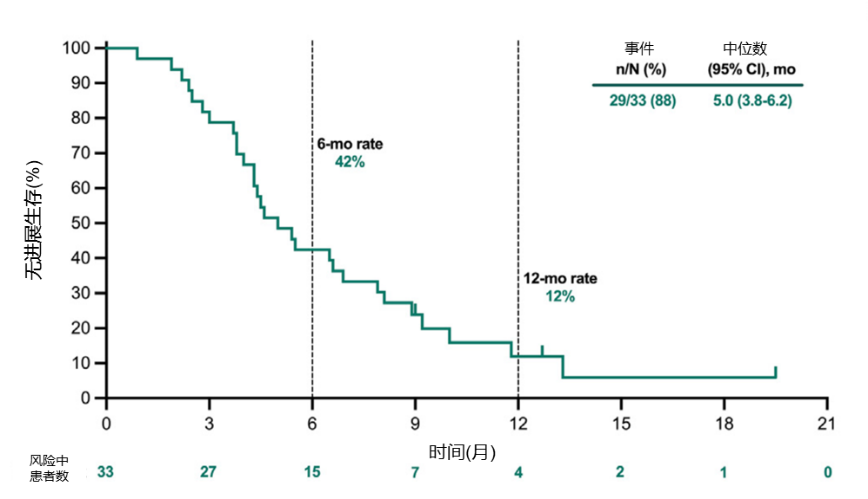
图3.总人群的PFS Kaplan-Meier曲线
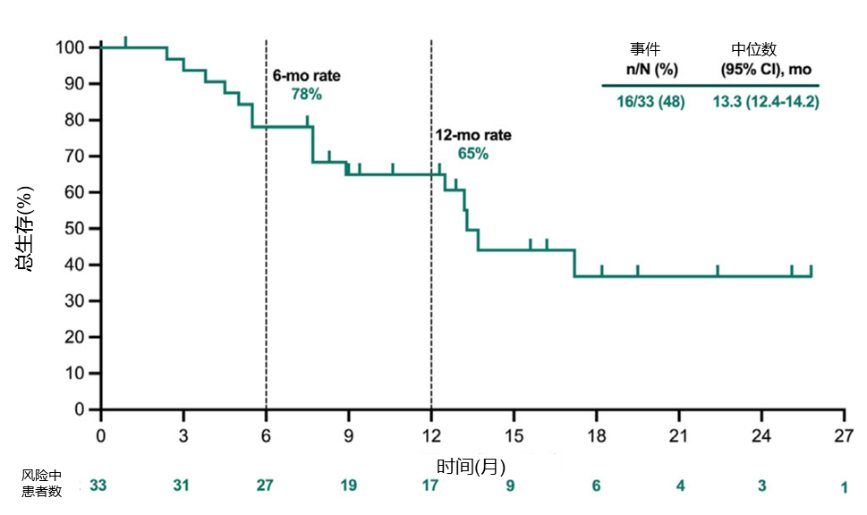
图4.总人群的OS Kaplan-Meier曲线
亚组分析显示,所有亚组的PFS和OS一致获益(校正后P均>0.05),包括年龄、ECOG状态、组织学类型、既往全身治疗线数、既往贝伐珠单抗/PARP抑制剂使用情况、PFI时长、BRCA状态和同源重组缺陷状态。
-
CA125降幅或可预测疗效,从而优化后续治疗策略
第一治疗周期后CA125降幅≥50%的患者PFS显著优于CA125降幅<50%的患者(中位PFS:7.9 vs 3.7个月,P=0.003;图5),OS也呈现延长趋势(中位OS:17.2 vs 13.2个月,P=1.000;图6)。
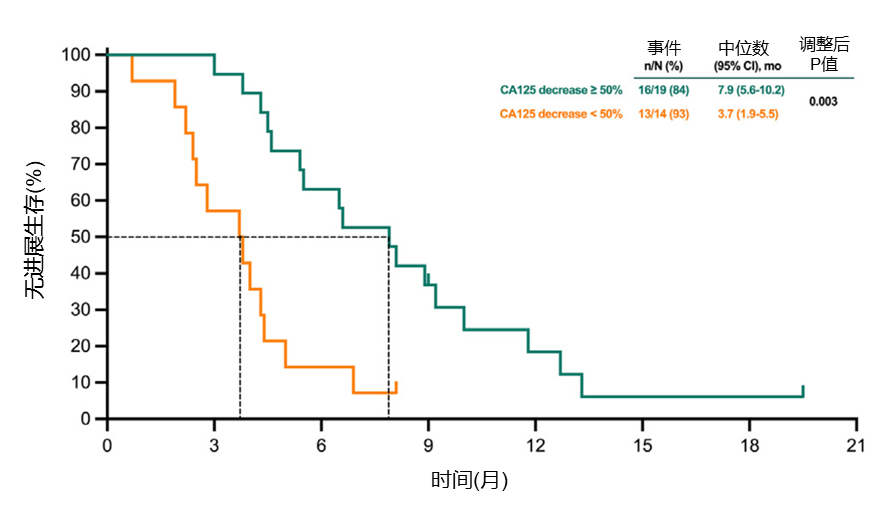
图5.第一周期治疗后CA125下降≥50%与下降<50%患者的PFS Kaplan-Meier曲线
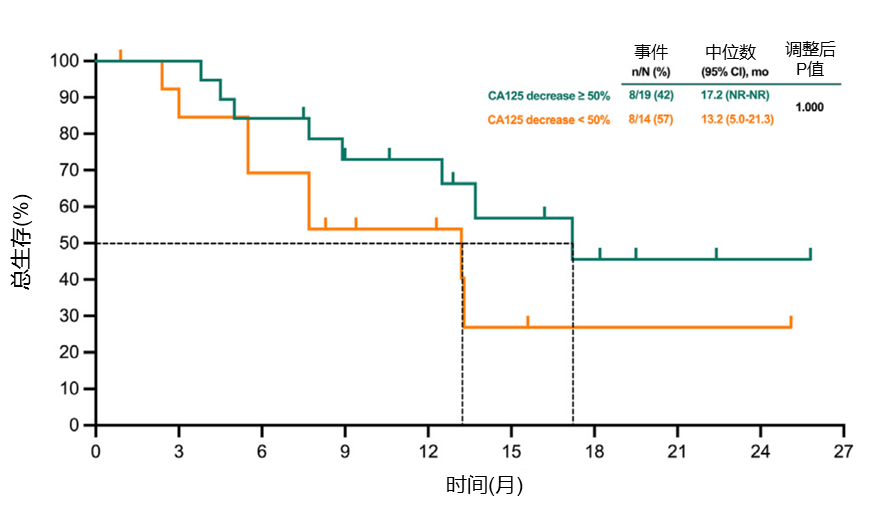
图6.第一周期治疗后CA125下降≥50%与下降<50%患者的OS Kaplan-Meier曲线
-
创新联合方案展现良好安全性,患者耐受性改善
32例(97%)患者出现TRAE,其中39%为3级TRAE(最常见的是高血压、中性粒细胞减少症、血小板减少症和关节痛);无4-5级TRAE发生。4例(12%)患者因TRAE单次降低了仑伐替尼剂量,治疗中断率和停药率分别为42%和12%。
研究收集了患者在研究治疗进展后的治疗信息,事后探索性分析显示,在治疗进展后接受铂类药物再挑战的患者似乎重新获得了铂敏感性。
该研究初步结果表明,对于卵巢癌患者,在多次复发和多线治疗后出现的继发性铂耐药,以及一线治疗期间出现原发性铂难治的情况下,尽管采用低剂量仑伐替尼联合抗PD-1单抗策略,结果仍显示出持久的临床获益。这些发现为支持该联合疗法在卵巢癌中的应用进一步增添了探索性证据。同时,该方案也有望降低毒性风险和节省成本,最终提升成本效益并扩大治疗可及性。
综上,低剂量仑伐替尼联合特瑞普利单抗的有效减毒方案有望成为多线治疗失败的复发性PROC患者的替代治疗方案。研究团队将继续完成患者入组并开展全面的生物标志物分析,以验证这些初步发现。最终研究结果预计将于2027年12月公布。
关于特瑞普利单抗注射液(拓益®)
特瑞普利单抗注射液(拓益®)作为我国批准上市的首个国产以PD-1为靶点的单抗药物,获得国家科技重大专项项目支持,并荣膺国家专利领域最高奖项“中国专利金奖”。
特瑞普利单抗至今已在全球(包括中国、美国、欧洲及东南亚等地)开展了覆盖超过15个适应症的40多项由公司发起的临床研究。正在进行或已完成的关键注册临床研究在多个瘤种范围内评估特瑞普利单抗的安全性及疗效,包括肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、肾癌及皮肤癌等。
截至目前,特瑞普利单抗已在中国内地获批12项适应症:【1】用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗(2018年12月);【2】用于既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌患者的治疗(2021年2月);【3】用于含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性尿路上皮癌的治疗(2021年4月);【4】联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗(2021年11月);【5】联合紫杉醇和顺铂用于不可切除局部晚期/复发或远处转移性食管鳞癌患者的一线治疗(2022年5月);【6】联合培美曲塞和铂类用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌的一线治疗(2022年9月);【7】联合化疗围手术期治疗,继之本品单药作为辅助治疗,用于可切除IIIA-IIIB期非小细胞肺癌的成人患者(2023年12月);【8】联合阿昔替尼用于中高危的不可切除或转移性肾细胞癌患者的一线治疗(2024年4月);【9】联合依托泊苷和铂类用于广泛期小细胞肺癌一线治疗(2024年6月);【10】联合注射用紫杉醇(白蛋白结合型)用于经充分验证的检测评估PD-L1阳性(CPS≥1)的复发或转移性三阴性乳腺癌的一线治疗(2024年6月);【11】联合贝伐珠单抗用于不可切除或转移性肝细胞癌患者的一线治疗(2025年3月);【12】用于不可切除或转移性黑色素瘤的一线治疗(2025年4月)。2020年12月,特瑞普利单抗首次通过国家医保谈判,目前已有10项获批适应症纳入《国家医保目录(2024年)》,是目录中唯一用于黑色素瘤、非小细胞肺癌围手术期、肾癌、三阴性乳腺癌治疗的抗PD-1单抗药物。2024年10月,特瑞普利单抗用于复发/转移性鼻咽癌治疗的适应症在中国香港获批。
在国际化布局方面,特瑞普利单抗目前已在美国、欧盟、印度、英国、约旦、澳大利亚、新加坡等国家和地区获得批准上市,并在全球多个国家和地区接受上市审评。
参考来源:
Hao Su, Xiao Shang, et al. Low-dose lenvatinib plus toripalimab for patients with platinum-resistant recurrent ovarian cancer: preliminary results from a multicenter, phase II trial (NCT06241105). Gynecol Oncol 2025; DOI: 10.1016/j.ygyno.2025.06.023