12月15日,美国旧金山和中国苏州——信达生物制药集团(香港联交所股票代码:01801),一家致力于研发、生产和销售肿瘤、自身免疫、代谢及心血管、眼科等重大疾病领域创新药物的生物制药公司,宣布:信尔美®(胰高血糖素[GCG] /胰高血糖素样肽-1[GLP-1] 双受体激动剂,玛仕度肽注射液)获中国澳门特别行政区药品监管部门批准上市,用于成人肥胖或超重患者的长期体重控制。截至目前,信达生物多款创新产品已在印度尼西亚、中国香港、中国澳门、中国台湾等多个国家或地区获批上市。
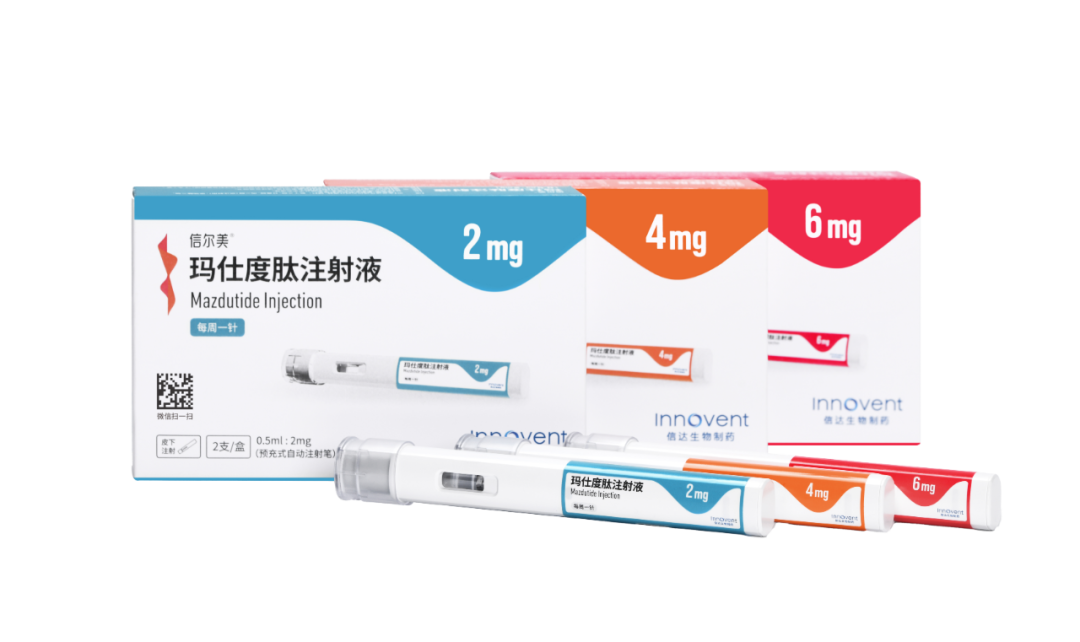
信尔美®(玛仕度肽注射液)是全球首个用于体重管理的GCG/GLP-1双受体激动剂。其独特的双激动作用机制,在激动GLP-1受体抑制食欲减少热量摄入的基础上,同时激活GCG受体,促进脂肪燃烧,降低内脏脂肪含量,进一步增强玛仕度肽减重效果。临床研究表明,使用玛仕度肽可实现强效减重,降低肝脏脂肪含量超 80%2,腰围减少达11cm2,颈围减少达3cm3,兼顾改善血糖、血压、血脂、血尿酸和转氨酶水平等心血管及代谢指标2,带来全面获益,获评2025年全球十大最受期待药物之一(FIERCE Pharma 2025),其研究成果发表于《新英格兰医学杂志》,并特配专家评述1。
今年10月,玛仕度肽在Ⅲ期临床试验DREAMS-3(试验登记号:NCT06184568)中达成主要终点,研究结果显示,在中国2型糖尿病(T2D)合并肥胖患者中,玛仕度肽在血糖控制与体重管理的综合疗效显著优于司美格鲁肽,并在空腹血糖、腰围、收缩压、甘油三酯等多项心血管代谢风险因素上展现出更优改善效果。
值得一提的是,此次获批的玛仕度肽注射液在设计上充分兼顾患者使用的便利性与安全性。一次性注射笔杜绝交叉污染风险;产品采用隐针设计,其特有的X切面针头经对比研究证实,可减轻注射疼痛感、提升皮肤穿刺顺畅度,助力患者获得更舒适的注射体验4。这些设计细节不仅提升了用药便捷性,更有助于提高患者的长期治疗依从性,为临床应用增添了实用优势。
作为中国领先的生物制药企业,信达生物已建立包含30余个新药品种的产品管线,覆盖肿瘤、自身免疫、代谢、眼科等重大疾病领域。此次玛仕度肽在澳门获批,不仅为澳门肥胖症患者带来突破性的体重管理方案,也为提升澳门公共卫生水平和推动医疗创新发展注入新动力。信达生物将继续秉持“开发出老百姓用得起的高质量生物药”的使命,推动更多创新药物走向更广阔的市场,惠及全球患者。
关于玛仕度肽(IBI362)
玛仕度肽(IBI362)是信达生物与礼来制药共同推进的一款胰高血糖素(GCG)/胰高血糖素样肽-1(GLP-1)双受体激动剂。作为一种哺乳动物胃泌酸调节素(OXM)类似物,玛仕度肽除了通过激动GLP-1R促进胰岛素分泌、降低血糖和减轻体重外,还可通过激动GCGR增加能量消耗增强减重疗效,同时改善肝脏脂肪代谢。玛仕度肽已在多项临床研究中展现出优秀的减重和降糖疗效,以及降低腰围、血脂、血压、血尿酸、肝酶及肝脏脂肪含量,以及改善胰岛素敏感性,带来多重代谢获益。
玛仕度肽当前共开展或完成了七项III期临床研究,包括:
在中国超重或肥胖参与者中开展的III期临床研究(GLORY-1);
在中国中重度肥胖参与者中开展的III期临床研究(GLORY-2);
在初治的中国2型糖尿病患者中开展的III期临床研究(DREAMS-1);
在口服药物治疗血糖控制不佳的中国2型糖尿病参与者中开展的对比玛仕度肽和度拉糖肽的III期临床研究(DREAMS-2);
在中国2型糖尿病合并肥胖的参与者中开展的对比玛仕度肽和司美格鲁肽的III期临床研究(DREAMS-3);
在中国超重或肥胖合并代谢相关脂肪性肝病(MAFLD)参与者中开展的III期临床研究(GLORY-3);
在中国阻塞性睡眠呼吸暂停(OSA)合并肥胖参与者中开展的III期临床研究(GLORY-OSA)。
其中,前五项III期临床研究均已达成终点,后两项III期临床研究还在进行中。
此外,玛仕度肽还有多项新临床研究进行中,其中包括:治疗青少年肥胖,代谢相关脂肪性肝炎(MASH),射血分数保留心力衰竭(HFpEF),及更高剂量头对头替尔泊肽治疗中重度肥胖等临床研究。
玛仕度肽凭借出色的研究数据多次获得学术及行业内的认可。玛仕度肽此前在中国超重/肥胖受试者中进行的II期临床研究被国际顶尖期刊Nature Communications评选为临床转化医学领域最重要的50个研究之一并被列为主编精选研究。同时,玛仕度肽被知名医药领域网站FIERCE Pharma评入2025全球十大最受期待创新药榜单。除此之外,玛仕度肽的临床研究结果多次亮相《新英格兰医学杂志》(The New England Journal of Medicine), Nature Communications , Diabetes Care , eClinicalMedicine等国际知名期刊和美国糖尿病协会(ADA)科学会议、欧洲糖尿病研究学会(EASD)年会等学术大会,是中国内分泌代谢领域首个临床研究成果发布在《新英格兰医学杂志》的创新药物,体现了其重要的临床意义。
*玛仕度肽已获NMPA批准两项适应症,第一项为在控制饮食和增加体力活动基础上对成人患者的长期体重控制,初始体重指数(BMI)为:
BMI≥28 kg/m2(肥胖),或
BMI≥24 kg/m2(超重),并伴有至少一种体重相关的合并症(例如高血糖、高血压、血脂异常、脂肪肝、阻塞性睡眠呼吸暂停综合征等)。
第二项适应症为用于成人2型糖尿病患者的血糖控制:
单药治疗
单纯饮食控制和运动干预后血糖仍控制不佳的成人2型糖尿病患者;
联合治疗
在饮食控制和运动基础上,接受二甲双胍和/或磺脲类药物、接受二甲双胍和/或钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)类药物治疗血糖仍控制不佳的成人2型糖尿病患者。
关于信达生物
“始于信,达于行”,开发出老百姓用得起的高质量生物药,是信达生物的使命和目标。信达生物成立于2011年,致力于研发、生产和销售肿瘤、自身免疫、代谢、眼科等重大疾病领域的创新药物,让我们的工作惠及更多的生命。公司已有17个产品获得批准上市,它们分别是信迪利单抗注射液(达伯舒®),贝伐珠单抗注射液(达攸同®),阿达木单抗注射液(苏立信®),利妥昔单抗注射液(达伯华®),佩米替尼片(达伯坦®),奥雷巴替尼片(耐立克®), 雷莫西尤单抗注射液(希冉择®),塞普替尼胶囊(睿妥®),伊基奥仑赛注射液(福可苏®),托莱西单抗注射液(信必乐®),氟泽雷塞片(达伯特®),匹妥布替尼片(捷帕力®),己二酸他雷替尼胶囊(达伯乐®),利厄替尼片(奥壹新®)和替妥尤单抗N01注射液(信必敏®),玛仕度肽注射液(信尔美®)和匹康奇拜单抗注射液(信美悦®)。目前,同时还有1个品种在NMPA审评中,4个新药分子进入III期或关键性临床研究,另外还有15个新药品种已进入临床研究。
公司已与礼来、罗氏、赛诺菲、Incyte和MD Anderson 癌症中心等国际合作方达成30多项战略合作。信达生物在不断自研创新药物、谋求自身发展的同时,秉承经济建设以人民为中心的发展思想。多年来,始终心怀科学善念,坚守“以患者为中心”,心系患者并关注患者家庭,积极履行社会责任。公司陆续发起、参与了多项药品公益援助项目,让越来越多的患者能够得益于生命科学的进步,买得到、用得起高质量的生物药。截至目前,信达生物患者援助项目已惠及20余万普通患者,药物捐赠总价值36亿元人民币。信达生物希望和大家一起努力,提高中国生物制药产业的发展水平,以满足百姓用药可及性和人民对生命健康美好愿望的追求。
声明:
1.信达不推荐任何未获批的药品/适应症使用。
2.雷莫西尤单抗注射液(希冉择®),塞普替尼胶囊(睿妥®)和匹妥布替尼片(捷帕力®)由礼来公司研发。
参考文献:
1. Ji L, et al. N Engl J Med. 2025 May 25. doi: 10.1056/NEJMoa2411528
2. Data from Phase 2 study of mazdutide 9mg, data on file.
3. Data from the Phase 2 study of Mazdutide 9 mg, data on file.
4. Amer Jaber, et al. BMC Neurology. October 10, 2008. doi: 10.1186/1471-2377-8-38
5. Ultra-fine needle patent number: CN1169320A